Электролиз. Примеры расчета

Электролиз можно производить только постоянным током. При электролизе на отрицательном электроде (катоде) выделяется водород или металл, содержащийся в соли. Если положительный электрод (анод) выполнен из металла (обычно того же, что и в соли), то положительный электрод при электролизе растворяется. Если анод нерастворим (например, угольный), то содержание металла в электролите при электролизе уменьшается.
Количество вещества, выделяющегося при электролизе на катоде, пропорционально количеству электричества, которое протекло через электролит.
Количество вещества, выделенное одним кулоном электричества, называется электрохимическим эквивалентом A, поэтому G=A•Q; G=A•I•t,
где G – количество выделенного вещества; Q – количество электричества; I – электрический ток; t – время.
Каждый металл имеет свой электрохимический эквивалент A.
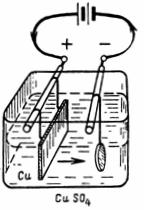
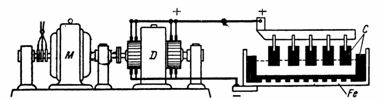
1. Сколько меди выделится из медного купороса (CuSO4) (рис. 1) током I=10 А за 30 мин. Электрохимический эквивалент меди A=0,329 мг/A•сек.
G = A•I•t = 0,329•10•30•60 = 5922 мг =5,922 г.
На предмете, подвешенном к катоду, выделится 5,9 г чистой меди.
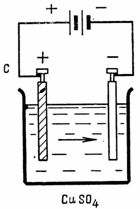
2. Допустимая плотность тока при электролитическом меднении •=0,4 А/дм2. Площадь катода, которая должна покрыться медью, S=2,5 дм2. Какой ток необходим для электролиза и сколько меди выделится на катоде за 1 ч (рис. 2 ).
I=••S =0,4-2,5=l A; G=A•Q=A•I•t=0,329•1•60•60=1184,4 мг.
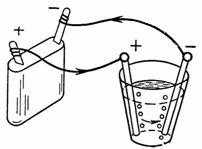
3. Окисленная вода (например, слабый раствор серной кислоты H2SO4) при электролизе разлагается на водород и кислород. Электроды могут быть угольные, оловянные, медные и т. д., но лучше всего из платины. Сколько кислорода выделится на аноде и сколько водорода выделится на катоде за 1/4 ч при токе 1,5 А. Количество электричества 1 А•сек выделяет 0,058 см3 кислорода и 0,116 см3 водорода (рис. 3 ).
На катоде выделится Gа=A•I•t=0,058•1,5•15•60=78,3 см3 кислорода.
На аноде выделится Gк=A•I•t=0,1162•1,5•15•60=156,8 см3 водорода.
Смесь водорода и кислорода в такой пропорции называется гремучим газом, который при поджигании взрывается с образованием воды.
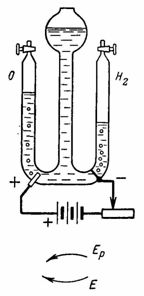
4. Кислород и водород для лабораторных опытов получают при помощи электролиза воды (окисленной серной кислотой) (рис. 4 ). Платиновые электроды впаяны в стекло. Установим с помощью сопротивления ток I=0,5 А. (В качестве источника тока используется батарея из трех сухих элементов по 1,9 В.) Сколько водорода и кислорода выделится через 30 мин.
Рис. 4 . Рисунок к примеру 4
В правом сосуде выделится Gк=А•I•t=0,1162•0,5•30•60=104,58 см3 водорода.
В левом сосуде выделится Ga=A•l•t=0,058•0,5•30•60=52,2 см3 кислорода (газы выталкивают воду в средний сосуд).
5. Преобразовательная установка (двигатель-генератор) обеспечивает ток для получения электролитической (чистой) меди. За 8 ч необходимо получать 20 кг меди. Какой ток должен обеспечить генератор• Электрохимический эквивалент меди равен A=0,329 мг/А•сек.
Так как G=A•I•t, то I=G/(A•t)=20000000/(0,329•8•3600)=20000000/9475,2=2110,7 А.
6. Нужно отхромировать 200 фар, из которых на каждую требуется 3 г хрома. Какой ток необходим, чтобы эта работа была выполнена за 10 ч (электрохимический эквивалент хрома A=0,18 мг/А•сек).
7. Алюминий получают путем электролиза раствора каолиновой глины и криолита в ваннах при рабочем напряжении ванны 7 В и токе 5000 А. Аноды изготовляются угольными, а ванна – стальной с угольными блоками (рис. 5 ).
Рис. 5 .Рисунок к примеру 5
Ванны для получения алюминия соединяются последовательно для увеличения рабочего напряжения (например, 40 ванн). Для получения 1 кг алюминия требуется примерно 0,7 кг угольных анодов и 25–30 кВт•ч электроэнергии. По приведенным данным определить мощность генератора, расход электроэнергии за 10 ч работы и вес полученного алюминия.
Мощность генератора при работе на 40 ванн P=U•I=40•7•5000=1400000 Вт =1400 кВт.
Электрическая энергия, расходуемая за 10 ч, A=P•t=1400 кВт 10 ч=14000 кВт•ч.
Количество полученного алюминия G=14000 : 25=560 кг.
Исходя из теоретического электрохимического эквивалента, количество полученного алюминия должно быть равно:
Gт=A•I•t=0,093•5000•40•10•3600=0,093•7200000000 мг=669,6 кг.
Коэффициент полезного действия электролитической установки равен: кпд=G/Gт =560/669,6=0,83=83%.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Источник
Напряжение разложения



Теоретические основы промышленного электролиза.
Электроды присоединяются к внешнему источнику электрического тока следующим образом:
анод — к положительному полюсу;
катод — к отрицательному полюсу.
При наличии напряжения на электродах катионы электролита движутся к катоду, а анионы – к аноду.
Химическая сущность электролиза заключается в окислительно-восстановительных реакциях.
На аноде анионы отдаютэлектроны, т. е. окисляются.
На катоде катионы принимают электроны, т. е. восстанавливаются.
В результате этого на электродах разряжаются ионы с образованием газообразных, жидких или твёрдых электрически нейтральных веществ.
При этом идёт диссоциация новых молекул электролита, и восстанавливается равновесие, нарушенное при разряде ионов.
В зависимости от цели процесса электроды могут быть изготовлены из различных материалов: металлов или графита.
Металлические электроды могут быть растворимыми и нерастворимыми.
Растворимые электроды принимают участие в окислительно-восстановительных процессах, протекающих при электролизе, а нерастворимые – нет.
Если металлический анод растворим в электролите, то равновесие диссоциации восстанавливается путём перехода в раствор катионов металла анода.
В электролите обычно присутствует несколько видов ионов. В водных растворах электролитов присутствуют молекулы воды (слабый электролит) и катионы металлов или ионы водорода, а также анионы кислот и гидроксогруппы (результаты диссоциации сильных электролитов: солей, кислот и щелочей).
При электролизе водных растворов электролитов катионы движутся к катоду. На катоде конкурируют процессы восстановления ионов металлов и водорода из воды:
Mt n+ + nê = Me
2H2O + 2ê = H2 + 2OH —
Анионы при электролизе подходят к аноду. На аноде конкурируют процессы окисления анионов и кислорода из воды:
2Cl — — 2ê = Cl2
2H2O — 4ê = O2 + 4H +
На катоде в первую очередь восстанавливаются более сильные окислители.
На аноде в первую очередь окисляются более сильные восстановители.
Для теоретического предсказания схемы электролиза в общем случае нужно рассчитывать напряжение разложения.
В первую очередь идут процессы, требующие меньшего напряжения разложения.
Напряжение разложения (Uразл.) – минимальное напряжение (наименьшая разность потенциалов), которое необходимо приложить от внешнего источника для протекания процесса электролиза при данных температуре и концентрации раствора.
Напряжение разложения слагается из потенциала поляризации (∆Eполяр.) и перенапряжения на катоде и аноде:
Значения ηк и ηа для электродов, изготовленных из различных материалов, имеются в справочниках
Величина перенапряжения зависит от природы процесса и очень многих факторов (концентрации, температуры, материал электрода и т. д.).
Сначала мы с вами введём понятия потенциала поляризации и перенапряженя на аноде и катоде;а затем рассмотримрасчёт напряжения разложения на примере электролиза водного раствора хлорида
никеля (II).
В водном растворе хлорид никеля диссоциирует по схеме:
NiCl2 = Ni 2+ + 2Cl —
Положительно заряженные ионы никеля подходят к катоду, на котором происходит их восстановление:
Катод (-) Ni 2+ + 2ê = Ni
На аноде окисляются ионы хлора:
Анод (+) 2Cl — — 2ê = Cl2
Суммарный процесс при электролизе в ионно-молекулярной форме:
Ni 2+ + 2Cl — = Cl2 + Ni
Выделение никеля на катоде и хлора на аноде приводит к возникновению хлорно-никелевого гальванического элемента:
(-) Ni | Ni 2+ || Cl2 | Cl — (+)
Равновесие на электроде, покрытом никелем:
Ni 2+ + 2ê = Ni E 0 Ni 2+ |Ni = -0,25 В
Равновесие на хлорном электроде:
Если принять, что концентрации ионов никеля и хлора являются стандартными (1 моль/л), то при установлении равновесия на каждом из электродов возникнет скачёк потенциала, равный стандартному электродному потенциалу.
Никелевый электрод в образовавшемся гальваническом элементе будет восстановителем, хлорный электрод выступит в роли окислителя:
Ni 0 — 2e = Ni 2+
Cl2 + 2e = 2Cl —
Ni + Cl2 = Ni 2+ + 2Cl —
Суммарный процесс Ni + Cl2 = Ni 2+ + 2Cl — ,в случае гальванического элемента, характеризуется разностью потенциалов

∆E 0 = ∆E 0 окисл. — ∆E 0 восст. = 1,36 — (-0,25) = 1,61 В.
Разность потенциалов возникшего гальванического элемента и есть ∆E 0 поляр.
Источник
Электролиз — принцип действия, назначение и применение
Процессы, протекающие при электролизе

Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов — получение возможно более чистых незагрязненных примесями веществ.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация — распад на положительно и отрицательно заряженные ионы.
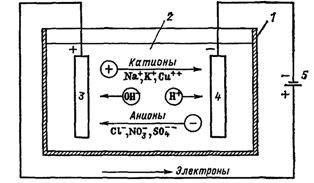
Если в сосуд с электролитом — электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы — катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы — анионы (хлор, кислород) — к аноду.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Рис. 1. Процессы, протекающие при электролизе. Схема электролизной ванны: 1 — ванна, 2 — электролит, 3 — анод, 4 — катод, 5 — источник питания
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).

Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Таблица 1. Нормальные электродные потенциалы при +25° С
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов.
Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
1. Масса вещества m э, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества I τ : m э = α / τ , здесь а — электрохимический эквивалент вещества, г/Кл.
2. Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n : m э = А / 96480 n , здесь 96480 — число Фарадея, Кл х моль -1 .
Таким образом, электрохимический эквивалент вещества α = А / 96480 n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества — кулоном (ампер-секундой).
Для меди А = 63,54, n = 2, α = 63,54/96480 -2 = 0,000329 г/Кл, для никеля α = 0,000304 г/Кл, для цинка α = 0,00034 г/Кл.

Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса m э = η1 х ( А / 96480 n) х It
Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Напряжение U эл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Ер (разность потенциалов анодной и катодной реакций), суммы анодного и катодного перенапряжений падения напряжения в электролите Еп, падения напряжения в электролите U э = IR эп ( R эп — сопротивление электролита), падения напряжения в шинах, контактах, электродах U с = I ( R ш+ R к+ R э). Получаем: U эл = Ер + Еп + U э + U с.
Мощность, потребляемая при электролизе, равна: Рэл = IU эл = I (Ер + Еп + U э + U с)
Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IU э, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии . Ее можно найти по выражению q э = (αη1)/ U эл100, здесь α — электрохимический эквивалент вещества, г/Кл, η1 — выход по току, U эл — напряжение на электролизере, В.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Источник